Crédit: Laboratoire Poietis
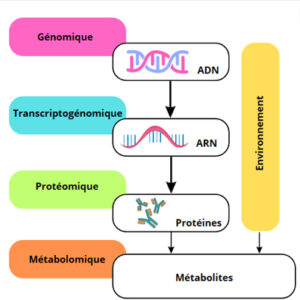
In vitro signifie dans le verre. Les réactions se font en dehors de l'organisme. Le but est de se concentrer principalement sur la réaction en elle-même.
Les méthodes in vitro sont de plus en plus utilisées non seulement lors des étapes de screening (technique d’identification de composés chimiques), mais aussi au cours du développement du médicament. Leur facilité de mise en œuvre, leur isolement de tout contexte physiologique qui permet d’étudier un mécanisme d’action toxique, et surtout la possibilité d’utiliser des cellules humaines qui permettent de s’affranchir des différences inter-espèces, en font un outil incontournable.
Cellules souches
Crédit: Depositphotos
Une cellule souche est une cellule indifférenciée, capable de s'auto renouveler, de se différencier en d'autres types cellulaires et de proliférer en culture.
Les cellules souches sont issues le plus souvent de déchets chirurgicaux humains destinés à l'incinération comme, par exemple, de cellules que l'on trouve dans la peau et dans les tissus adipeux.
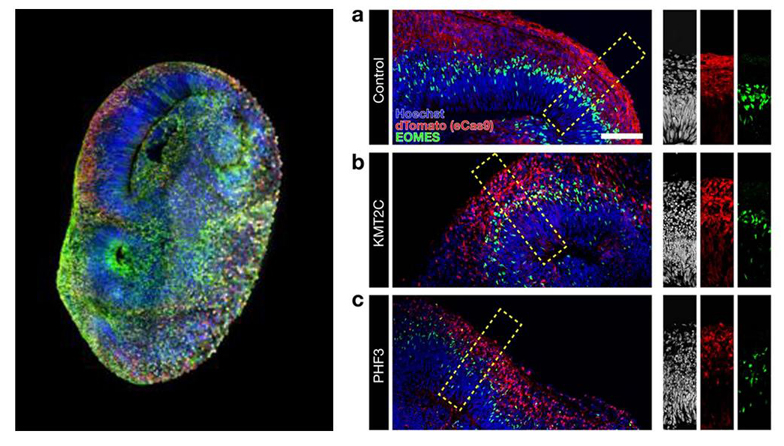
Avec les avancées technologiques, il est possible de programmer ces cellules souches adultes. Elles peuvent donner naissance à quasiment tous les différents types de cellules de l’organisme, elles sont pluripotentes et appelées iPSC pour cellules souches pluripotentes induites (induced pluripotent stem cells). Grâce à leurs propriétés, ces cellules peuvent servir à régénérer ou recréer des tissus détruits. On utilise des cellules souches pour concevoir des organes et organoïdes sur puce.
Les organes et organoïdes sur puce
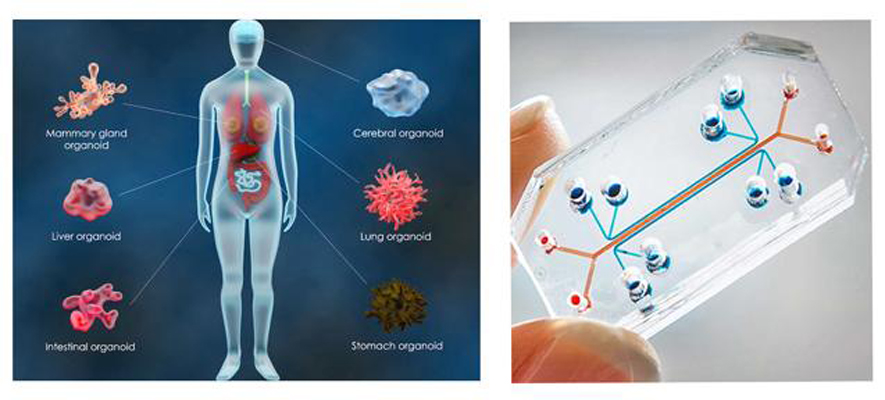
Crédit: iStock
Les organoïdes ou organes sur puce ont pour but de mimer l'architecture et le fonctionnement des organes.
Ces dispositifs sont composés de cellules humaines, cultivées au sein d’un microenvironnement, dans des valves ponctuées de canaux dont la connexion est rendue possible par la technologie de la microfluidique.
Il est conçu afin que les cellules puissent simuler différentes fonctions du corps humain.
Il est donc possible avec cette technologie d’étudier la propagation d’un pathogène ou la diffusion d’un médicament dans un organe ou l’ensemble des organes cultivés. Il est aussi possible de simuler les interactions des organes entre eux avec puces multi-organes.
Les organoïdes se trouvent être les structures cellulaires en 3D mimant l’architecture et le fonctionnement de l’organe entier. Ils sont notamment obtenus à partir de cellules souches pluripotentes induites (iPSC).
Des avantages certains en comparaison à l'utilisation d'animaux
- Étudie de façon précise l'impact de la réaction chimique
- Propose une facilité de culture et des avantages économiques pour la production de l'industrie pharmaceutique
- Se base sur le métabolisme humain et non animal pour les études toxicologiques
Quelques applications
Les organoïdes sur puce pour étudier les tumeurs cancéreuses
Crédit: Depositphotos
Le projet 3D glimpse vise à créer une tumeur sur puce afin de mieux comprendre et traiter le glioblastome, un cancer très agressif avec une survie moyenne d’un an après diagnostic. Dans cette puce, on va chercher à représenter le micro-environnement tumoral via l'utilisation de différents types de cellules humaines s'organisant en 3D afin de former des micro-vaisseaux. Ceux-ci seront perfusés pour mimer le flux sanguin afin d’étudier le transport et l’efficacité de nouveaux nano-médicaments.
Le foie sur puce pour analyser la toxicité des molécules à visée thérapeutique
Le projet MimLiveronChip est une plateforme biomimétique de Foie sur puce. Développé pour recréer l’analyse du métabolisme du foie et de la toxicité des xénobiotiques. MimLiveronChip cherche plus particulièrement à explorer les effets du microenvironnement mécanique ou biochimique influençant l’ouverture de la monocouche du foie, afin de pouvoir la générer ou au contraire de l’altérer.
La thérapie cellulaire
Crédit: Depositphotos
La thérapie cellulaire consiste à utiliser des iPSC (cellules souches pluripotentes induites) ou des cellules multipotentes provenant du patient ou d’un donneur pour greffer des cellules afin de restaurer la fonction d’un tissu ou d’un organe. L’objectif est de soigner durablement le patient grâce à une injection unique de cellules thérapeutiques. La thérapie cellulaire peut également être utilisée dans la fabrication notamment des organoïdes.