
La difficile évaluation des perturbateurs endocriniens
Et si les NAM étaient la solution ?
Contribution du Dr. Jean-Pierre Cravedi, Toxicologue, ancien directeur de recherche INRAE
L’objet de cet article n’est pas de revenir dans le détail sur les perturbateurs endocriniens (PE), sujet qui a déjà fait l’objet d’une publication dans un précédent numéro de la revue (SES115 – déc. 2024), mais plutôt de souligner les difficultés inhérentes à ces substances lorsque l’on souhaite statuer sur le risque qu’elles présentent pour la population. Bien que les PE soient également un défi en matière d’impact environnemental, nous n’aborderons ici que le volet santé humaine de la problématique.
Rappelons que l’évaluation des risques associés à une substance nécessite de connaître à la fois l’exposition à cette substance, mais également la toxicité (danger) que celle-ci présente pour l’organisme exposé. Si renseigner l’exposition aux PE ne comporte aucune singularité en comparaison à d’autres types de substances, il n’en va pas de même concernant leurs effets nocifs. En effet, les données recueillies depuis une trentaine d’années montrent que ces derniers ont quelques particularités en matière de relation dose-effet, d’effets toxiques décalés dans le temps ou encore de synergie d’effets. À ces observations qui ne sont pas forcément l’exclusivité des PE, s’ajoutent des interrogations sur la pertinence des modèles animaux pour évaluer de tels effets.
Les effets des faibles doses d’exposition
Les effets des PE peuvent survenir à de très faibles doses, ce qui n’est pas surprenant puisqu’ils miment souvent les hormones qui ont la propriété d’agir à d’infimes concentrations. Pour ne prendre qu’un exemple citons celui du bisphénol A (BPA) une substance de synthèse utilisée notamment en plasturgie (en particulier pour les matériaux plastiques polycarbonates) et classée sur la liste des substances extrêmement préoccupantes par l’agence européenne des produits chimiques (ECHA) depuis 2017 en raison de ses propriétés de perturbateur endocrinien responsables d’effets sévères sur la santé humaine. Sur la base des données toxicologiques alors disponibles, l’autorité européenne de sécurité sanitaire des aliments (EFSA) avait établi, en 2006 une dose journalière tolérable (DJT) de 50 µg/kg de poids corporel/jour, permettant de conclure qu’en-dessous de ce seuil d’exposition, le BPA ne présentait aucun risque pour la santé pour l’ensemble de la population, compte tenu des niveaux d’expositions estimés (EFSA, 20061). En raison de données toxicologiques supplémentaires sans lien direct avec la perturbation endocrinienne, la DJT a été revue à la baisse par l’EFSA en 20152 pour être fixée à 4 µg/kg de poids corporel/ jour. Un nouvel avis, publié en avril 2023 par l’EFSA établissait la DJT à 0,0002 µg/kg de poids corporel/jour, soit une valeur 250 000 fois plus faible que celle calculée 17 ans plus tôt (EFSA, 20233). Cet écart considérable tient à la prise en compte de cibles qui n’avaient pas été examinées auparavant (système immunitaire et inflammation), à l’intégration dans le processus d’évaluation de davantage de données humaines, et à une meilleure connaissance des mécanismes d’action du BPA à l’échelle cellulaire et moléculaire. Si c’est le système immunitaire qui a été finalement retenu par les experts de l’EFSA comme la cible la plus sensible aux effets du BPA, la toxicité sur le développement et la reproduction, ou encore sur le métabolisme, directement en lien avec les propriétés de PE du BPA a également été observée à des doses plusieurs milliers de fois plus faibles que celles ayant entraîné des effets sur le foie ou les reins chez les animaux, ayant servi de base à l’avis de l’EFSA de 2015. Cet effet à très faible dose du BPA, dû à des diverses interférences avec les mécanismes de régulation hormonale chez plusieurs espèces, avait été décrit il y a plus de douze ans par certains scientifiques (vom Saal FS, Hughes, 20054 ; Vandenberg et al. 20135). Finalement, sur la base de cette nouvelle DJT et des données d’exposition disponibles, l’EFSA alertait en 2023 sur le fait que l’exposition au BPA par voie alimentaire était préoccupante pour la santé dans toutes les tranches d’âge de la population générale.
Les courbes doses-réponses non monotones
Une autre particularité en lien avec la dose concerne les courbes doses-réponses non monotones qui ont été mises en évidence dans plusieurs études expérimentales concernant les PE. Les toxicologues ont coutume de dire que c’est la dose qui fait le poison, en d’autres termes que les effets sont d’autant plus accentués que la substance toxique est administrée à de fortes doses. Lorsque l’on reporte ces résultats sur un graphique, on parle alors de courbe monotone qui permet de dériver aisément une dose sans effet toxique et donc de proposer un seuil (Dose sans effet, DSE) au-dessous duquel il n’y a pas de risque (représenté en Figure 1).
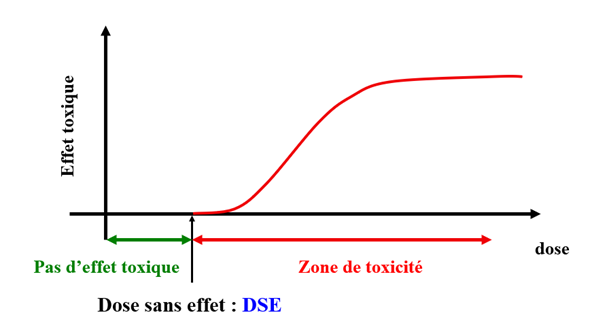
Figure 1 : Détermination de la dose sans effet à partir de l’administration de doses décroissantes d’une substance à un organisme. Crédits : Prof Jean-Pierre Cravedi
Toutefois, les effets engendrés par certains PE ne semblent pas toujours liés à la dose reçue par un individu. Certains effets apparaissent à de faibles doses, puis diminuent lorsque les doses augmentent, et s’accentuent à nouveau pour des doses plus élevées, ce qui entraîne des courbes doses-réponses en forme de U (relation dose-réponse non monotone) et remet en cause les méthodes habituelles d’évaluation du risque (Figure 2). Il devient dans ce cas beaucoup plus difficile de déterminer une dose sans effet. Si ces courbes doses-réponses non monotones ont été décrites depuis plus de 10 ans pour plusieurs PE, suggérant que ce type de courbe était plus fréquent pour les PE que pour d’autres agents toxiques (Vandenberg et al., 20126), elles ont fait l’objet de nombreux débats plus récents dans la communauté scientifique et les agences d’évaluation du risque (Lorenz et al., 20127 ; Lagarde et al., 20158 ; Hill et al., 20189). Beaucoup d’experts arrivèrent à la conclusion que les PE pouvaient donner lieu à des courbes doses-réponses non monotones, mais que la fréquence de l’événement était moins importante que suggéré par Vandenberg et al. (2012)10.
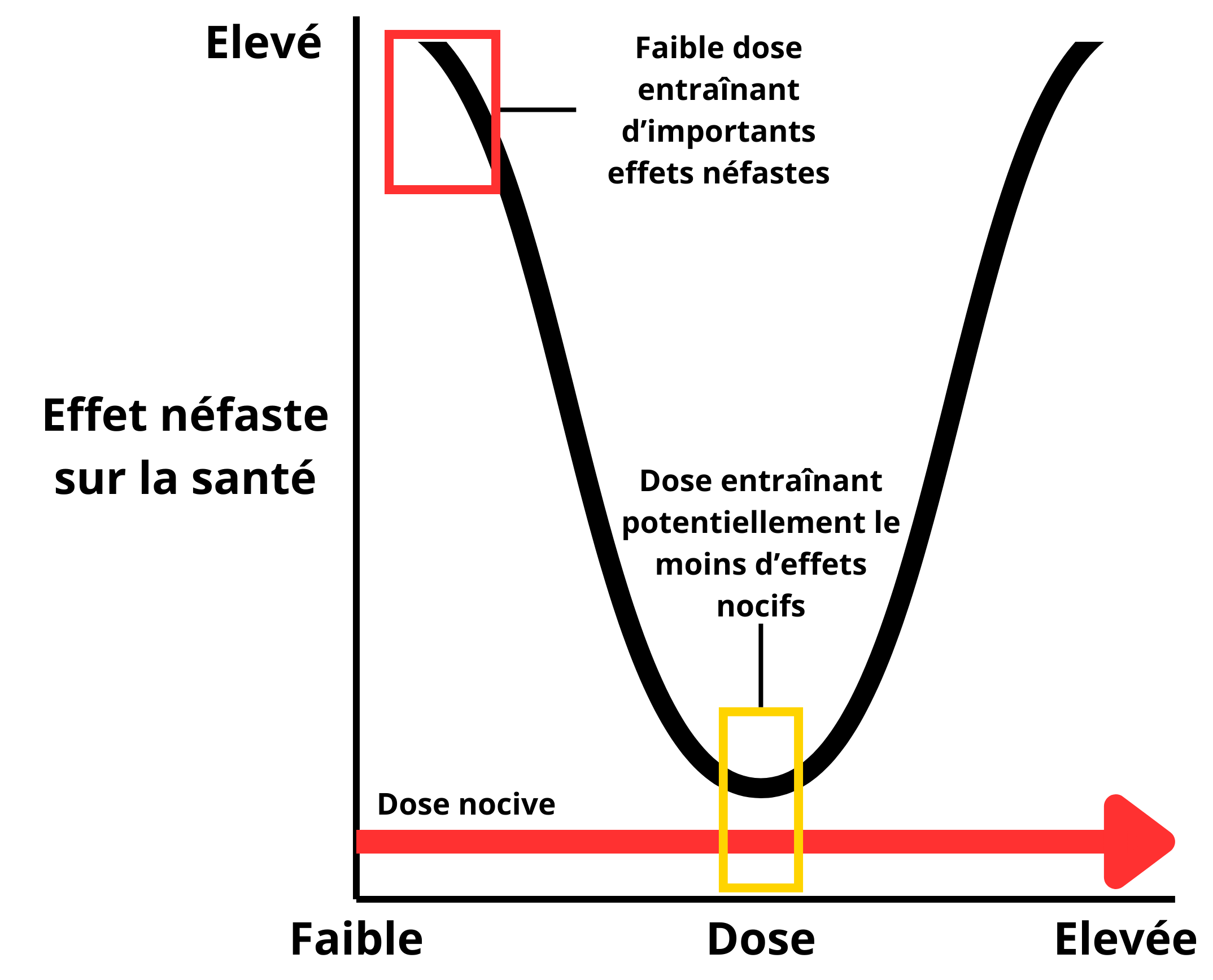
Figure 2 : Courbe dose-réponse non monotone (en U). Dans ce cas, des effets toxiques peuvent se produire à de faibles doses alors qu’ils peuvent être moins prononcés à des doses moyennes. Adapté de Vandenberg et al. 201211.
Aujourd’hui, les agences sanitaires admettent la plausibilité du phénomène pour plusieurs PE et certaines (ANSES, EFSA) proposent le recours aux NAM afin d’intégrer cette singularité dans l’évaluation du risque (Lagarde et al., 201512 ; Chevillotte et al., 2017a,b13,14 ; EFSA, 202115).
Les « fenêtres » de vulnérabilité
S’agissant des PE, il ne fait aucun doute que la période d’exposition, bien plus que la dose ou la durée d’exposition, joue un rôle déterminant dans les effets indésirables qu’ils produisent. La « fenêtre » d’exposition la plus sensible pour une majorité de PE est la période périnatale, c’est-à-dire celle qui couvre la vie fœtale et la petite enfance. Elle est à l’origine de la plupart des effets attribués à certains phtalates ou bisphénols, par exemple. Si l’on reprend l’exemple du distilbène (ou diéthylstilbestrol) déjà évoqué dans l’article précédent, ce médicament autrefois prescrit pour prévenir les fausses couches et les complications de grossesse, est responsable de cancers gynécologiques chez les femmes exposées in utero, entre la 6ème et la 17ème semaine de grossesse. En revanche, pour la mère traitée pendant sa grossesse à ce médicament il n’a pas été observé de risque accru de ce type de cancer. Il a été montré que la fréquence d’adénocarcinome vaginal chez les femmes exposées au distilbène in utero diminuait quand le traitement était prescrit plus tardivement au cours de la grossesse (O’Brien, 197916, Hoover et al., 201117).
La puberté est également une période de vulnérabilité vis-à-vis des PE. Dans ce contexte, la notion d’exposition tout au long de la vie, qui prévaut dans les modèles d’évaluation du risque d’exposition chronique, perd beaucoup de son intérêt.
Effets différés
Outre le fait qu’il existe une fenêtre de vulnérabilité concernant les PE, il a été découvert que les effets néfastes des PE pouvaient apparaître bien après que l’exposition se produise. Parmi les nombreux exemples de ces effets tardifs, citons celui de la dioxine, suite à l’accident de Seveso en Italie en 1976. La dioxine est un puissant perturbateur endocrinien qui a la propriété d’être persistant et d’être lentement éliminé dans le lait maternel chez les mammifères. Le suivi des populations exposées sur la zone de Seveso a montré que l’exposition périnatale à la dioxine pouvait entraîner, à l’âge adulte, une baisse significative de la qualité du sperme, et en particulier une diminution de moitié du nombre de spermatozoïdes par mL de sperme (Figure 3) (Mocarelli et al., 201118).
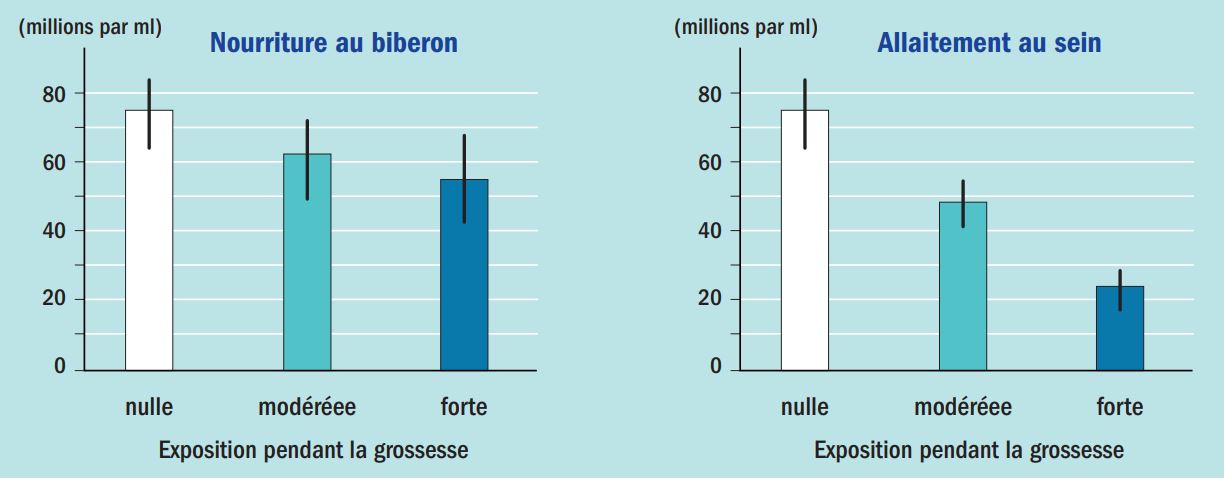
Figure 3 : Effet d’une exposition périnatale à la dioxine sur la quantité de spermatozoïdes. Les expositions sont qualifiées de nulle modérée ou forte en fonction d’estimations basées sur les concentrations en dioxine dans le sérum des mères au moment de l’accident. D’après Habert R. 202119.
Si les effets sont peu ou pas significatifs pour les individus nourris au biberon, même lorsque leur mère a été fortement exposée, les résultats deviennent très significatifs dans le cas d’un allaitement au sein. Ces données démontrent l’effet irréversible d’un PE survenant plus de 30 ans après l’exposition.
Impacts transgénérationnels
La poursuite des travaux sur les effets sanitaires du distilbène évoqués plus tôt montre des impacts non seulement sur les enfants des femmes traitées, mais également sur leurs petits- enfants (risques accrus de malformations). Ces observations suggèrent des impacts multi- ou transgénérationnels des PE, c’est-à-dire constatés chez des individus qui n’ont jamais été au contact du médicament ou de la substance toxique. Quelques travaux expérimentaux menés chez les rongeurs avec des PE tels que la vinclozoline, un fongicide aujourd’hui interdit, le bisphénol A ou encore certains phtalates montrent que les effets observés chez l’individu exposé peuvent se transmettre sur plusieurs générations (Brehm & Flaws, 201920). Bien qu’encore imparfaitement élucidés, les mécanismes impliqués sont probablement d’ordre épigénétique, c’est-à-dire faisant intervenir des modifications de l’environnement ou de l’expression des gènes sans changement de la séquence d’ADN (sans apparition de mutation).
Les effets des mélanges
Les « cocktails » de PE peuvent donner lieu à des effets synergiques ou potentialisateurs, c’est-à-dire que l’effet du mélange peut être supérieur à celui de chacune de ses composantes prises individuellement. Si ce phénomène n’est pas spécifique aux PE, il a été particulièrement mis en avant dans ce cas en raison des multiples cibles sur lesquelles ces molécules peuvent agir. Parmi plusieurs exemples d’interaction entre PE aboutissant à une toxicité plus grande du mélange comparativement à l’addition des effets de chacun des constituants, citons un travail expérimental chez le rat visant à comparer les effets sur la concentration en spermatozoïdes de deux PE, la vinchlozoline (décrite plus haut) et la génistéine (un phytoestrogène présent dans le soja) testés à différentes doses journalières pendant 80 jours allant de la période in utero à l’âge adulte. Les résultats de l’étude indiquent que l’effet le plus marqué (diminution de près de 50% du nombre de spermatozoïdes) est observé pour le mélange génistéine (dose de 1mg/kg) + vinchlozoline (dose de 1mg/kg), alors qu’aucun effet n’est obtenu lorsque chacune des substances est testée individuellement aux mêmes concentrations (Figure 4) (Eustache et al., 200921).
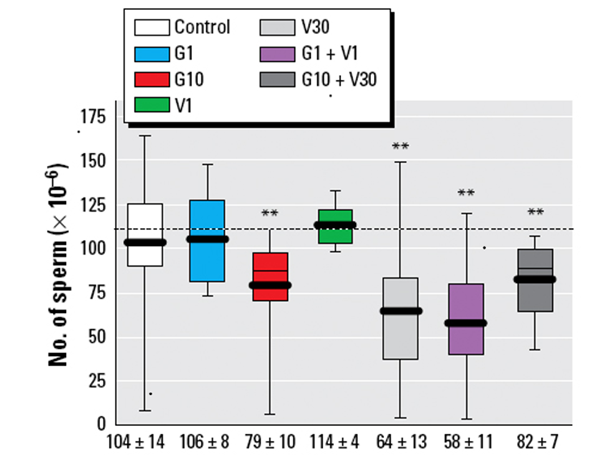
Figure 4 : Effet sur la qualité du sperme d’une exposition chronique individuelle ou combinée à de faibles doses de génistéine (G1, G10) et de vinchlozoline (V1, V30) chez le rat. D’après Eustache et al., (2009)22.
Des chercheurs français ont exploré les mécanismes à l’origine de ces synergies. Ils ont démontré que deux PE peuvent se fixer simultanément sur un même récepteur présent dans le noyau des cellules, augmentant ainsi la quantité de molécules fixées et créant un effet synergique qui perturbe la régulation de diverses fonctions physiologiques (Delfosse et al., 201523). L’élargissement de ces travaux à d’autres mélanges et à un couple de récepteur indique que des mélanges de trois PE peuvent augmenter très fortement la synergie d’un mélange binaire et que certains récepteurs peuvent interagir entre eux et amplifier la synergie mise en évidence à partir d’un seul récepteur (Delfosse et al., 202124). Dans les années à venir, l’association de ces méthodes de criblage moléculaire sur des récepteurs et de l’Intelligence Artificielle (IA) devrait permettre de prédire plus efficacement les effets cocktails présentant le plus de risque pour la santé.
La pertinence des modèles animaux remise en question
L’évaluation du risque est généralement fondée sur des données issues d’expérimentations animales qui servent de base à la détermination d’une dose sans effet. S’agissant d’endocrinologie, il est toutefois bien connu que des différences importantes existent en fonction des espèces. La littérature scientifique rapporte de nombreux exemples de ces différences et les experts s’interrogent fréquemment sur le bien-fondé des extrapolations à l’humain de données collectées chez l’animal. Concernant la problématique des PE, c’est probablement l’équipe de René Habert qui a le plus attiré l’attention des instances d’évaluation sur les incertitudes associées à ces extrapolations. Cette équipe a par exemple pu montrer que le testicule fœtal humain était cent fois plus sensible au bisphénol A que le testicule fœtal de rat ou de souris. Au contraire, en utilisant le même modèle expérimental, le diéthylstilbestrol n’entraîne aucun effet chez l’homme, alors qu’il freine le développement des spermatozoïdes et diminue la production de testostérone chez la souris et chez le rat. Quant à leurs études sur les phtalates, elles mettent en évidence une réduction du développement des futurs spermatozoïdes pendant la vie fœtale aussi bien chez l’homme que chez le rat, mais une diminution de la production testiculaire de testostérone uniquement chez le rat et pas chez l’homme (Habert et al., 201425).
L’ensemble de ces travaux a montré d’une part que la transposition des résultats de l’animal à l’homme introduisait un niveau supplémentaire (et sans doute inutile) de complexité et que par ailleurs certaines voies de toxicité pour l’homme ne peuvent pas être testées sur des animaux. En Europe, plusieurs initiatives ont émergé pour améliorer le diagnostic des maladies et des dysfonctionnements liés aux PE, sans pour autant recourir aux tests sur animaux. Parmi elles, citons le projet néerlandais AFARA (Animal-Free Assays for endocrine disruption – from science to Regulatory Acceptance) auquel participent plusieurs équipes françaises qui a débuté en 2023. Ce projet entend développer l’utilisation de modèles sans animaux pour l’identification des PE et faciliter l’acceptation de ces modèles en matière d’évaluation du risque.
PE et NAM : est-ce compatible ?
Les spécificités qui viennent d’être évoquées et la complexité des mécanismes impliqués dans la perturbation endocrinienne rendent difficiles la caractérisation de leurs effets néfastes à long terme et remettent en cause les principes de la toxicologie classique. Plus que d’autres catégories de substances, les PE requièrent des approches nouvelles pour en évaluer le risque. Parmi ces approches, le recours à des données provenant de NAM afin de permettre une évaluation plus rapide, une meilleure compréhension des mécanismes de toxicité et une priorisation des évaluations est une démarche recommandée par plusieurs auteurs et agences (Barton-McLaren, 202226 ; Svingen et al., 202227 ; US-EPA, 202328). Ces méthodes comprennent le développement de modèles in silico (toxicologie computationnelle), d’essais basés sur des modèles moléculaires, cellulaires, ou tissulaires (organoïdes ou organes-sur-puce) le plus souvent en combinaison et en s’appuyant sur les outils de la bio-informatique et de la biologie des systèmes pour extraire efficacement l’information et favoriser une approche intégrative. Elles représentent un arsenal de plus en plus complet et performant pour répondre aux défis sanitaires posés par les PE.
Dans le cas des PE, il existe néanmoins un défi majeur à la substitution des approches de la toxicologie classique par les NAM. Il tient à la définition réglementaire des PE qui exige que trois critères soient remplis pour qu’une substance soit considérée PE :
- un effet indésirable sur un organisme intact ou sa descendance ;
- une activité endocrinienne (ou un mode d’action endocrine) ;
- l’effet indésirable est une conséquence du mode ou du mécanisme d’action endocrinien.
En raison de ces critères de classification, un nombre limité de substances sont aujourd’hui identifiées comme étant des PE. Si l’on souhaite exclusivement s’appuyer sur les NAM pour évaluer le risque des PE, le critère de l”« effet indésirable sur un organisme intact » pose problème et peut difficilement être rempli sans avoir recours à des tests (ou une batterie de tests) in vivo. Sans révision des critères réglementaires actuels, il est de ce fait probable, dans un premier temps, que les méthodes alternatives soient uniquement utilisées pour répondre aux critères 2 et 3 et dans une plus large mesure pour sélectionner les substances à étudier en priorité. Il n’est toutefois pas exclu que ce défi conduise à revoir les critères réglementaires concernant les PE (Svingen, 202229).
Ces obstacles n’empêchent pas la recherche de progresser et de proposer des alternatives aux méthodes en vigueur dans la caractérisation du danger des PE et dans l’appréciation du risque sanitaire qu’ils font courir aux populations. Un groupe de chercheurs impliqués dans le projet européen PARC, auquel le Comité Pro Anima contribue, a récemment publié un plaidoyer en faveur des NAM dans le cadre de l’identification et de la caractérisation des PE impliqués dans la perturbation métabolique. Cet article donne un aperçu des approches et des méthodes alternatives développées dans le projet PARC et montre comment elles contribueront à l’identification des PE et à la mise en évidence de leur mécanisme d’action (Braeuning, 202330).
A propos de l’auteur
Dr Jean-Pierre Cravedi
 Toxicologue, président du Conseil scientifique d’Aprifel, ancien expert de l’ANSES et de l’EFSA.
Toxicologue, président du Conseil scientifique d’Aprifel, ancien expert de l’ANSES et de l’EFSA.
Cet ancien directeur de recherche INRAE, a notamment dirigé l’UMR Xénobiotiques, à Toulouse, avant d’être chef de département adjoint pour le département Alimentation Humaine de 2014 à 2019. Ses travaux l’ont conduit à étudier le devenir et les effets de plusieurs contaminants présents dans l’environnement ou dans l’alimentation, dont les perturbateurs endocriniens.
Dr Jean-Pierre Cravedi est également depuis 2025 président du comité stratégique du Prix Descroix-Vernier EthicScience.
Références
* NAM = Nouvelles Approches Méthodologiques
(1) EFSA, Opinion of the Scientific Panel on food additives, flavourings, processing aids and materials in contact with food (AFC) related to 2,2‑BIS(4‑HYDROXYPHENYL)PROPANE, EFSA Journal 2006 ; EFSA Journal. https://doi.org/10.2903/j.efsa.2007.428.
(2) EFSA, Scientific Opinion on the Risks to Public Health Related to The Presence of bisphenol A (BPA) in foodstuffs, EFSA Journal 2015, 13(1):3978, 1040 pp.
(3) EFSA, Scientific opinion on the re-evaluation of the risks to public health related to the Presence of Bisphenol A (BPA) in Foodstuffs, EFSA Journal 2023, 21(4):6857, 392 pp.
(4) vom Saal FS, Hughes C. Bisphenol A : vom Saal and Hughes Respond, Environ Health Perspect 2006 Jan., 114(1):A16 – 7.
(5) Vandenberg LN, Ehrlich S, Belcher SM, Ben-Jonathan N, Dolinoy DC, Hugo ER, Hunt PA, Newbold RR, Rubin BS, Saili KS, Soto AM, Wang HS, & vom Saal FS, Low dose effects of bisphenol A, Endocrine Disruptors 2013, 1:1. DOI : 10.4161/endo.26490.
(6) Vandenberg LN, Colborn T, Hayes TB, Heindel JJ, Jacobs DR Jr, Lee DH, et al., Hormones and endocrine-disrupting chemicals : low-dose effects and nonmonotonic dose-responses, Endocr Rev 2012, 33, 378 – 455 pp. 10.1210/er.2011 – 1050.
(7) Lorenz R, Rhomberg LR, Goodman JE. Low-dose effects and nonmonotonic dose – responses of endocrine disrupting chemicals : Has the case been made?, Regulatory Toxicology and Pharmacology 2012, 64:1, 130 – 133 pp.
(8) Lagarde, F., Beausoleil, C., Belcher, S.M. et al. Non-monotonic dose-response relationships and endocrine disruptors : a qualitative method of assessment, Environ Health 2015, 14:13. https://doi.org/10.1186/1476 – 069X-14 – 13.
(9) Hill CE, Myers JP, Vandenberg LN, Nonmonotonic Dose-Response Curves Occur in Dose Ranges That Are Relevant to Regulatory Decision-Making, Dose Response 2018 Sep., 13;16(3):1559325818798282. DOI : 10.1177/1559325818798282.
(10) Chevillotte G, Bernard A, Varret C, Ballet P, Bodin L, and Roudot AC, 2017a, Probabilistic assessment method of the non-monotonic dose-responses-Part I : methodological approach. Food and Chemical Toxicology 2017, 106, 376 – 385 pp.
(11) Chevillotte G, Bernard A, Varret C, Ballet P, Bodin L, and Roudot AC, 2017b, Probabilistic assessment method of the non-monotonic dose-responses-Part II : robustness assessment, Food and Chemical Toxicology 2017, 110, 214 – 228 pp.
(12) EFSA, Scientific Committee, Opinion on the Impact of non-monotonic Dose Responses on EFSA’s Human Health Risk Assessments, EFSA Journal 2021, 19:10:e06877.
(13) O’Brien PC, Nouer KL, Robboy SJ, Bames AB, Kaufman RH, Tilley BC, Vaginal epithelial changes in young human enrolled in the National Cooperative Diethylstilbestrol Adenosis (DESAD) project. Obstet Gynecol l979, 43 : 300 – 8.
(14) Hoover, R.N.; Hyer, M.; Pfeiffer, R.M.; Adam, E.; Bond, B.; Cheville, A.L.; Colton, T.; Troisi, R. Adverse Health Outcomes in Women Exposed in Utero to Diethylstilbestrol. N. Engl. J. Med. 2011, 365, 1304 – 1314.
(15) Mocarelli P, Gerthoux PM, Needham LL, Patterson DG Jr, Limonta G, Falbo R, Signorini S, Bertona M, Crespi C, Sarto C, Scott PK, Turner WE, Brambilla P, Perinatal exposure to low doses of dioxin can permanently impair human semen quality, Environ Health Perspect 2011 May, 119:5, 713 – 8.
(16) Habert R., Les perturbateurs endocriniens : des toxiques spécifiques ; adsp n° 115 septembre 2021.
(17) Brehm E, Flaws JA, Transgenerational Effects of Endocrine-Disrupting Chemicals on Male and Female Reproduction, Endocrinology 2019, 160:6, 1421 – 1435 pp.
(18) Eustache F, Mondon F, Canivenc-Lavier MC, et al. Chronic dietary exposure to a low-dose mixture of genistein and vinclozolin modifies the reproductive axis, testis transcriptome, and fertility. Environ Health Perspect. 2009;117(8):1272 – 1279. doi:10.1289/ehp.0800158
(19) Delfosse V, Dendele B, Huet T, Grimaldi M, Boulahtouf A, Gerbal-Chaloin S, Beucher B, Roecklin D, Muller C, Rahmani R, Cavaillès V, Daujat-Chavanieu M, Vivat V, Pascussi JM, Balaguer P, Bourguet W, Synergistic activation of human pregnane X receptor by binary cocktails of pharmaceutical and environmental compounds, Nat Commun 2015 Sep., 3;6:8089.
(20) Delfosse V, Huet T, Harrus D, Granell M, Bourguet M, Gardia-Parège C, Chiavarina B, Grimaldi M, Le Mével S, Blanc P, Huang D, Gruszczyk J, Demeneix B, Cianférani S, Fini JB, Balaguer P, Bourguet W, Mechanistic insights into the synergistic activation of the RXR-PXR heterodimer by endocrine disruptor mixtures, Proc Natl Acad Sci USA 2021 Jan., 5;118(1):e2020551118.
(21) Habert R, Muczynski V, Grisin T, et al., Concerns about the widespread use of rodent models for human risk assessments of endocrine disruptors, Reproduction 2014, 147(4), 119 – 29.
(22) Barton-Maclaren TS, Wade M, Basu N, Bayen S, Grundy J, Marlatt V, Moore R, Parent L, Parrott J, Grigorova P, Pinsonnault-Cooper J, Langlois VS, Innovation in regulatory approaches for endocrine disrupting chemicals : The journey to risk assessment modernization in Canada, Environmental Research 2022, Part C, 204:112225.
(23) Svingen T, Schwartz CL, Rosenmai AK, Ramhøj L, Johansson HKL, Hass U, et al., Using Alternative Test Methods to Predict Endocrine Disruption and Reproductive Adverse Outcomes : Do We Have Enough Knowledge?, Environ. Pollut. 2022, 304:119242.
(24) U.S. Environmental Protection Agency, Availability of New Approach Methodologies (NAMs) in the Endocrine Disruptor Screening Program (EDSP), EPA 2023, EPA-HQ-OPP-2021 – 0756.
(25) Svingen T, Endocrine Disruptors in a New Era of Predictive Toxicology and Dealing With the « More is Different » Challenge, Front Toxicol 2022 Apr, 27;4:900479.
(26) Braeuning A, Balaguer P, Bourguet W, Carreras-Puigvert J, Feiertag K, Kamstra JH, Knapen D, Lichtenstein D, Marx-Stoelting P, Rietdijk J, Schubert K, Spjuth O, Stinckens E, Thedieck K, van den Boom R, Vergauwen L, von Bergen M, Wewer N and Zalko D, Development of new approach methods for the identification and characterization of endocrine metabolic disruptors — a PARC project, Front. Toxicol 2023, 5:1212509.
- EFSA, Opinion of the Scientific Panel on food additives, flavourings, processing aids and materials in contact with food (AFC) related to 2,2‑BIS(4‑HYDROXYPHENYL)PROPANE, EFSA Journal 2006 ; EFSA Journal. https://doi.org/10.2903/j.efsa.2007.428.
- EFSA, Scientific Opinion on the Risks to Public Health Related to The Presence of bisphenol A (BPA) in foodstuffs, EFSA Journal 2015, 13(1):3978, 1040 pp.
- EFSA, Scientific opinion on the re-evaluation of the risks to public health related to the Presence of Bisphenol A (BPA) in Foodstuffs, EFSA Journal 2023, 21(4):6857, 392 pp.
- vom Saal FS, Hughes C. Bisphenol A : vom Saal and Hughes Respond, Environ Health Perspect 2006 Jan., 114(1):A16 – 7.
- Vandenberg LN, Ehrlich S, Belcher SM, Ben-Jonathan N, Dolinoy DC, Hugo ER, Hunt PA, Newbold RR, Rubin BS, Saili KS, Soto AM, Wang HS, & vom Saal FS, Low dose effects of bisphenol A, Endocrine Disruptors 2013, 1:1. DOI : 10.4161/endo.26490.
- Vandenberg LN, Colborn T, Hayes TB, Heindel JJ, Jacobs DR Jr, Lee DH, et al., Hormones and endocrine-disrupting chemicals : low-dose effects and nonmonotonic dose-responses, Endocr Rev 2012, 33, 378 – 455 pp. 10.1210/er.2011 – 1050.
- Lorenz R, Rhomberg LR, Goodman JE. Low-dose effects and nonmonotonic dose – responses of endocrine disrupting chemicals : Has the case been made?, Regulatory Toxicology and Pharmacology 2012, 64:1, 130 – 133 pp.
- Lagarde, F., Beausoleil, C., Belcher, S.M. et al. Non-monotonic dose-response relationships and endocrine disruptors : a qualitative method of assessment, Environ Health 2015, 14:13. https://doi.org/10.1186/1476 – 069X-14 – 13.
- Hill CE, Myers JP, Vandenberg LN, Nonmonotonic Dose-Response Curves Occur in Dose Ranges That Are Relevant to Regulatory Decision-Making, Dose Response 2018 Sep., 13;16(3):1559325818798282. DOI : 10.1177/1559325818798282.
- Vandenberg LN, Colborn T, Hayes TB, Heindel JJ, Jacobs DR Jr, Lee DH, et al., Hormones and endocrine-disrupting chemicals : low-dose effects and nonmonotonic dose-responses, Endocr Rev 2012, 33, 378 – 455 pp. 10.1210/er.2011 – 1050.
- Vandenberg LN, Colborn T, Hayes TB, Heindel JJ, Jacobs DR Jr, Lee DH, et al., Hormones and endocrine-disrupting chemicals : low-dose effects and nonmonotonic dose-responses, Endocr Rev 2012, 33, 378 – 455 pp. 10.1210/er.2011 – 1050.
- Lagarde, F., Beausoleil, C., Belcher, S.M. et al. Non-monotonic dose-response relationships and endocrine disruptors : a qualitative method of assessment, Environ Health 2015, 14:13. https://doi.org/10.1186/1476 – 069X-14 – 13.
- Chevillotte G, Bernard A, Varret C, Ballet P, Bodin L, and Roudot AC, 2017a, Probabilistic assessment method of the non-monotonic dose-responses-Part I : methodological approach. Food and Chemical Toxicology 2017, 106, 376 – 385 pp.
- Chevillotte G, Bernard A, Varret C, Ballet P, Bodin L, and Roudot AC, 2017b, Probabilistic assessment method of the non-monotonic dose-responses-Part II : robustness assessment, Food and Chemical Toxicology 2017, 110, 214 – 228 pp.
- EFSA, Scientific Committee, Opinion on the Impact of non-monotonic Dose Responses on EFSA’s Human Health Risk Assessments, EFSA Journal 2021, 19:10:e06877.
- O’Brien PC, Nouer KL, Robboy SJ, Bames AB, Kaufman RH, Tilley BC, Vaginal epithelial changes in young human enrolled in the National Cooperative Diethylstilbestrol Adenosis (DESAD) project. Obstet Gynecol l979, 43 : 300 – 8.
- Hoover, R.N.; Hyer, M.; Pfeiffer, R.M.; Adam, E.; Bond, B.; Cheville, A.L.; Colton, T.; Troisi, R. Adverse Health Outcomes in Women Exposed in Utero to Diethylstilbestrol. N. Engl. J. Med. 2011, 365, 1304 – 1314.
- Mocarelli P, Gerthoux PM, Needham LL, Patterson DG Jr, Limonta G, Falbo R, Signorini S, Bertona M, Crespi C, Sarto C, Scott PK, Turner WE, Brambilla P, Perinatal exposure to low doses of dioxin can permanently impair human semen quality, Environ Health Perspect 2011 May, 119:5, 713 – 8.
- Habert R., Les perturbateurs endocriniens : des toxiques spécifiques ; adsp n° 115 septembre 2021.
- Brehm E, Flaws JA, Transgenerational Effects of Endocrine-Disrupting Chemicals on Male and Female Reproduction, Endocrinology 2019, 160:6, 1421 – 1435 pp.
- Eustache F, Mondon F, Canivenc-Lavier MC, et al. Chronic dietary exposure to a low-dose mixture of genistein and vinclozolin modifies the reproductive axis, testis transcriptome, and fertility. Environ Health Perspect. 2009;117(8):1272 – 1279. doi:10.1289/ehp.0800158
- Eustache F, Mondon F, Canivenc-Lavier MC, et al. Chronic dietary exposure to a low-dose mixture of genistein and vinclozolin modifies the reproductive axis, testis transcriptome, and fertility. Environ Health Perspect. 2009;117(8):1272 – 1279. doi:10.1289/ehp.0800158
- Delfosse V, Dendele B, Huet T, Grimaldi M, Boulahtouf A, Gerbal-Chaloin S, Beucher B, Roecklin D, Muller C, Rahmani R, Cavaillès V, Daujat-Chavanieu M, Vivat V, Pascussi JM, Balaguer P, Bourguet W, Synergistic activation of human pregnane X receptor by binary cocktails of pharmaceutical and environmental compounds, Nat Commun 2015 Sep., 3;6:8089.
- Delfosse V, Huet T, Harrus D, Granell M, Bourguet M, Gardia-Parège C, Chiavarina B, Grimaldi M, Le Mével S, Blanc P, Huang D, Gruszczyk J, Demeneix B, Cianférani S, Fini JB, Balaguer P, Bourguet W, Mechanistic insights into the synergistic activation of the RXR-PXR heterodimer by endocrine disruptor mixtures, Proc Natl Acad Sci USA 2021 Jan., 5;118(1):e2020551118.
- Habert R, Muczynski V, Grisin T, et al., Concerns about the widespread use of rodent models for human risk assessments of endocrine disruptors, Reproduction 2014, 147(4), 119 – 29.
- Barton-Maclaren TS, Wade M, Basu N, Bayen S, Grundy J, Marlatt V, Moore R, Parent L, Parrott J, Grigorova P, Pinsonnault-Cooper J, Langlois VS, Innovation in regulatory approaches for endocrine disrupting chemicals : The journey to risk assessment modernization in Canada, Environmental Research 2022, Part C, 204:112225.
- Svingen T, Schwartz CL, Rosenmai AK, Ramhøj L, Johansson HKL, Hass U, et al., Using Alternative Test Methods to Predict Endocrine Disruption and Reproductive Adverse Outcomes : Do We Have Enough Knowledge?, Environ. Pollut. 2022, 304:119242.
- U.S. Environmental Protection Agency, Availability of New Approach Methodologies (NAMs) in the Endocrine Disruptor Screening Program (EDSP), EPA 2023, EPA-HQ-OPP-2021 – 0756.
- Svingen T, Endocrine Disruptors in a New Era of Predictive Toxicology and Dealing With the « More is Different » Challenge, Front Toxicol 2022 Apr, 27;4:900479.
- Braeuning A, Balaguer P, Bourguet W, Carreras-Puigvert J, Feiertag K, Kamstra JH, Knapen D, Lichtenstein D, Marx-Stoelting P, Rietdijk J, Schubert K, Spjuth O, Stinckens E, Thedieck K, van den Boom R, Vergauwen L, von Bergen M, Wewer N and Zalko D, Development of new approach methods for the identification and characterization of endocrine metabolic disruptors — a PARC project, Front. Toxicol 2023, 5:1212509.


