
Les enjeux des NAM
Ces dernières années, les enjeux de santé humaine et globale du XXIe siècle (risques chimiques et biologiques, effets cocktail, zoonoses, incidence des maladies) ont fait émerger le besoin grandissant d’une recherche biomédicale et de tests toxicologiques plus fiables et performants.
En santé humaine
Les Nouvelles Approches Méthodologiques (NAM) ne recourant pas aux animaux et centrées sur des données humaines sont en plein essor à l’échelle nationale et internationale. Elles reposent principalement sur des modèles in vitro ou in silico, et s’appuient souvent sur les outils de l’intelligence artificielle.
Généralement basées sur la connaissance des mécanismes d’action et des processus physiopathologiques, elles tendent à offrir, comparativement aux approches traditionnelles, une meilleure fiabilité pour l’humain et une compréhension accrue des maladies. A ces avantages s’ajoutent le potentiel d’accélérer et de rendre moins coûteux le développement de médicaments.

En matière d’évaluation du risque chimique
Outre le fait que les NAM donnent accès à des données recueillies sur des modèles humains et de ce fait permettent d’éviter les incertitudes liées à une extrapolation aux humains de tests effectués chez les animaux, elles sont susceptibles de répondre au défi majeur auquel se heurtent les instances d’évaluation face au nombre considérable de substances chimiques qui nous entourent et qui dépassent très largement les capacités de ces instances en termes de caractérisation du danger que présentent ces substances, seules ou en mélange. Compte-tenu du temps et des moyens qu’exigent les expérimentations animales, il est évident qu’elles ne peuvent plus constituer aujourd’hui le socle des procédures d’évaluation du risque et des recommandations de santé publique qui en découlent.

Une transition aux multiples avantages
La transition vers ces modèles, à la fois prédictifs, pertinents et performants représente une réelle opportunité en matière de perspectives de recherche publique et privée, d’évolution des procédures d’expertise et de progrès sanitaires. Des avantages économiques, de compétitivité et de souveraineté devraient en découler. En France, cette opportunité semble devoir être accompagnée plus concrètement.
Les tests sur animaux soulèvent aujourd’hui des préoccupations éthiques, scientifiques et sociétales grandissantes. Les revues et preuves scientifiques démontrent que les études basées sur l’animal ne permettent pas de prédire efficacement ce qui se passe chez l’humain, de par un manque de valeur translationnelle et de reproductibilité.
La communauté scientifique et les institutions reconnaissent qu’entre 80 et 99% des médicaments approuvés chez l’animal échouent lors des essais cliniques chez l’humain (The Flaws and Human Harms of Animal Experimentation / CNRS – PEPR MED-OOC / Analysis of animal-to-human translation).
En 2019, une étude publiée dans Drug Discovery Today présentait l’organe-sur-puce (OoC) comme une technologie émergente qui pourrait transformer l’efficacité de la recherche et du développement et réduire les coûts de 10 à 26 %.
La taille du marché des organes-sur-puces était évaluée à 116,5 millions de dollars en 2023 et devrait atteindre plus de 1,4 milliard de dollars d’ici 2032, en raison de la demande croissante de modèles in vitro d’organes humains plus précis et plus fiables pour la découverte de médicaments, les tests de toxicité, et modélisation des maladies.
Un rapport publié en 2023 par le Welcome Trust montre que l’IA pourrait permettre des économies de temps et d’argent d’au moins 25 à 50 % jusqu’au stade préclinique.
Un rapport de CSIRO Futures estime d’ailleurs qu’une industrie de modèles non animaux pourrait générer plus de 1,5 milliard de dollars et 5 000 emplois pour l’Australie d’ici 2040.
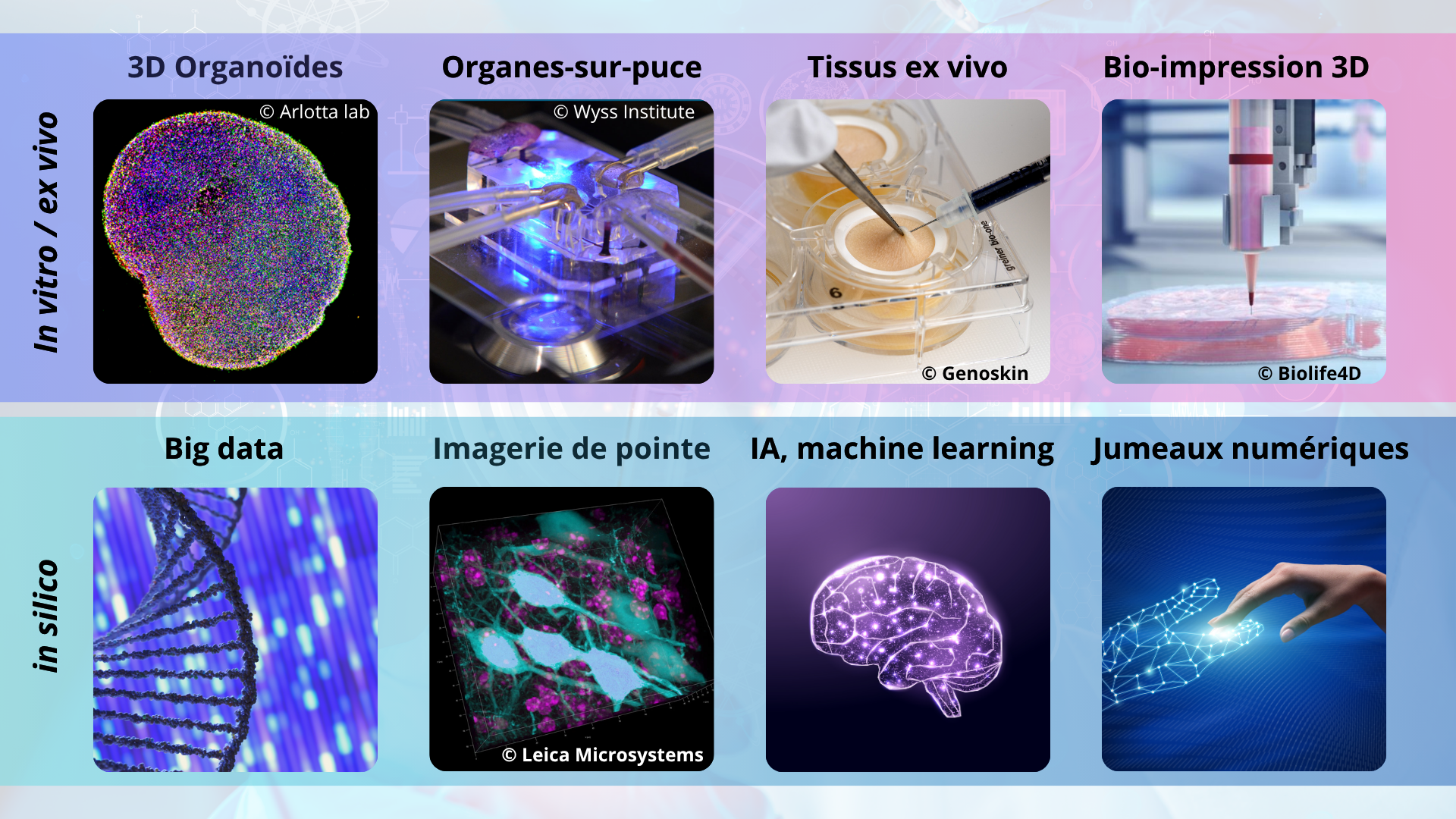
Des décisions fortes à travers le monde pour adresser ces enjeux et leur caractère systémique
Les plus significatives récemment prises viennent des Etats-Unis. La Food and Drug Administration (FDA) a publié en avril 2025 sa feuille de route pour améliorer la santé publique en remplaçant les tests sur animaux dans le développement des thérapies par anticorps monoclonaux et d’autres médicaments. La mise en œuvre de ce programme a débuté immédiatement pour les demandes de nouveaux médicaments expérimentaux (IND pour Investigational New Drug), où l’inclusion des données issues de NAM- est encouragée, et s’inscrit dans un cadre temporel court, de trois à cinq ans.
En parallèle à cette annonce, et afin d’intégrer ces sciences innovantes centrées sur l’humain, le NIH a annoncé créer l’Office of Research Innovation, Validation, and Application (ORIVA), au sein du Bureau du Directeur du NIH. Ce nouveau bureau coordonnera les efforts à l’échelle du NIH pour développer, valider et généraliser l’utilisation d’approches sans animaux dans l’ensemble du portfolio de recherche biomédicale de l’agence. Il servira également de centre de coordination inter-agences et de traduction réglementaire pour la protection de la santé publique.
En Europe et en France notamment, le fait que le tournant technologique actuel dans les sciences de la vie, des tests animaux traditionnels vers les systèmes microphysiologiques (MPS) et l’intelligence artificielle, promette une nouvelle ère de recherche biomédicale humaine, précise et éthique est évidemment considéré.
Parmi les pays européens les plus avancés et structurés, les Pays-Bas font office d’exemple, avec notamment en 2024 le financement gouvernemental du NGF (National Groeifinds) pour la création du Centre de Translation Biomédicale sans animaux (CPBT), aujourd’hui appelé Ombion Centre for Animal-free Biomedical Translation).
Ce centre national de valorisation et de diffusion des innovations et des savoir-faire sans animaux vise à améliorer et accélérer la translation des nouvelles innovations biomédicales auprès des patient(e)s et des utilisateur(rice)s, à moindre coût et sans recours aux animaux.
La Commission européenne travaille actuellement à l’élaboration d’une feuille de route de sortie progressive des tests sur animaux ; feuille de route qui devrait être adoptée pour le 1er trimestre 2026.



